La capacità di sedazione o anestesia di una Koi è necessità richiesta di volta in volta per salvare la vita di una Koi: fare il trattamento topico delle ulcere, iniettare un farmaco, rimuovere un oggetto bloccato in gola, suturare una larga ferita ecc.
Ho visto persone con capacità straordinarie nel catturare un pesce ed iniettare rapidamente un farmaco tenendo il pesce o bloccato tra l’avambraccio e il corpo del gestore o contro le pareti di una vasca di contenimento. Questa tecnica di iniezione rapida sarà forse utile per i grossisti e allevatori che devono trattare un numero elevato di pesci (le eventuali perdite risultanti sono un rischio accettato) mentre è particolarmente rischiosa, per i gravi danni interni causabili ad un pesce se la sostanza da iniettare ha bisogno di un tempo di iniezione prolungato o se la pur forte smussatura di un ago fa fatica ad entrare durante l’iniezione.
Questo tipo di approccio “prendi e pugnala” non è davvero necessario per l’hobbista dove ogni sua Koi è un tesoro o un esemplare da show.
Purtroppo è talvolta anche necessario portare la tecnica anestesiologica alle estreme conseguenze perchè, umanamente, l’eutanasia è l’unico rimedio alle sofferenze di una Koi.
Perchè la sedazione ?
La ricerca ha dimostrato come la nocicezione (processo sensoriale che rileva e convoglia i segnali e le sensazioni di dolore) nei pesci sia analogo a quello dei mammiferi; “I pesci sono esseri senzienti che condividono notevole fisiologia e biochimica con l’uomo “(Kreiberg, 2000). Praticare correttamente la sedazione e l’anestesia ci permette sia una movimentazione delle Koi con minori danni alla pelle ed al muco cutaneo, sia medicazioni invasive o piccoli interventi “chirurgici” tipo le suture.
Definizioni
ANESTESIA:
1) condizione di perdita di coscienza controllata e reversibile
2) riduzione sensoriale e responso motorio.
ANALGESIA:
1) temporanea assenza o riduzione di sofferenza
SEDAZIONE:
1) “anestesia leggera”
2) conveniente per piccole procedure non invasive come: manipolazione, pesatura, fotografia
3) sedazione chirurgica con anestesia locale
Quando si anestetizza una Koi, essa passa attraverso varie fasi infatti, una volta posizionata all’interno della soluzione acquosa preparata, si verifica quanto segue:
1. Movimento rapido delle branchie a volte frenetico “sputare” ;
2. Rallentamento dei movimenti delle branchie e parziale perdita di sensibilità al tatto ;
3. Perdita di equilibrio, movimento lento delle branchie dei pesci, ma reagirà quando maneggiato ;
4. I pesci si adagiano sul fondo della vasca di trattamento, con movimento branchiale infrequente e non rispondono alle sollecitazioni;
5. Nessun movimento branchiale e rilassamento muscolare; è la fase critica che può essere fatale se il pesce rimane nella miscela anestetica troppo lungo.
| Principali ragioni per la sedazione o l’anestesia |
| Cattura e procedure di trattamento medicali |
| Esaminazione clinica |
| Effettuazione di test diagnostici : antibiogramma, biopsia, raschiamenti cutanei |
| Suture chirurgiche |
Sappiamo tutti che durante la manipolazione delle Koi, oltre al rischio di danno meccanico, si innesca una complessa risposta fisiologica allo stress così provocato che è riassunta nella seguente tabella:
Fattori esterni di stress che agiscono sui recettori primari | ||
Risposta acuta primaria | Ipotalamo e la ghiandola pituitaria rilasciano ACTH; Cellule interrenali rilasciano corticosteroidi: Cortisolo – Cortisone | Tessuto cromaffine rilascia: Catecolamine Adrenalina Noradrenalina |
| Risposta secondaria cronica | Iperglicemia Leucocitosi Leucopenia | Bradicardia/Tachicardia Iperventilazione – Atassia Aumento del metabolismo, della perfusione branchiale della permeabilità branchiale Cambio del colore |
| Risposta terziaria cronica | Disturbi elettrolitici | Diminuzione di glicogeno epatico e delle riserve di proteine e lipifi |
| RIDUZIONE DELLA SOPPRAVVIVENZA | ||
Anche lo stress di una breve cattura con il retino può causare una persistente anoressia e la soppressione delle funzioni riproduttive.
Tra i molti effetti indotti da stress (elencati sopra), l’aumento dei livelli di adrenalina e cortisolo possono disturbare gli scambi ionici nelle branchie e di conseguenza modificare i valori ematici degli elettroliti (calcio, magnesio, sodio e altri) che possono essere osservati fino a 24 ore dopo l’evento che ha causato lo stress.
L’energia persa nel recupero da alterazioni legate allo stress possono lasciare i pesci meno capaci di lottare contro agenti patogeni o di adattarsi a variazioni di ossigeno o di temperatura.
| Strategie per mitigare la risposta allo stress | ||
| Azione | Applicazione | Commento |
| Ridurre la durata di esposizione allo stress | G | |
| Lavorare a basse temperature | G | Lo stress che induce mortalità è direttamente correlato alla temperatura |
| Prevenire simultanei fattori di stress | G | Effetti additivi o sinergici ; Lasciare intercorrere del tempo tra due fattori di stress |
| Uso di moderata salinità dell’acqua | T | Riduce lo stress osmotico. 12-15 ppt di salinità |
| Digiuno per 2 – 3 giorni | G / M / T | Riduce la richiesta di ossigeno e igliora la qualità dell’acqua |
| Riduzione della densità di stoccaggio | G / M / T | Riduce le interazioni |
| Provvedere ad un adeguato ambiente | G | |
| Usare la sedazione o una blanda anestesia | M / T | Riduzione del tasso metabolico e decremento del consumo di ossigeno. Riduzione dello stress e delle lesioni da eccitazione. Attenzione perchè entrambe potrebbero accrescere lo stress invece che ridurlo |
| Luce poco intensa o evitare l’esposizione | G | Può ridurre fino al 25% l’iperglicemia e l’ipocalcemia stress correlata. |
| Evitare brusche variazioni di temperatura | G / M | La temperatura dell’aria e dell’acqua deve essere simile durante la manipolazione. Acclimatazione attenta dei pesci nei trasferimenti. |
| Evitare variazioni del pH | G | Importante in acqua dolce |
| Evitare di danneggiare la mucosa cutanea | G / M / T | Il rivestimento mucoso cutaneo è essenziale per mantenere l’equilibrio osmotico e la prevenzione batterica, micotica o parassitaria. Indossare guanti bagnati in quanto il sudore umano contiene enzimi che possono danneggiare la cute. Utilizzo di reti può essere dannoso. |
G = generale M = manipolazione del pesce T = Trasporto del pesce (Ross, 1999)
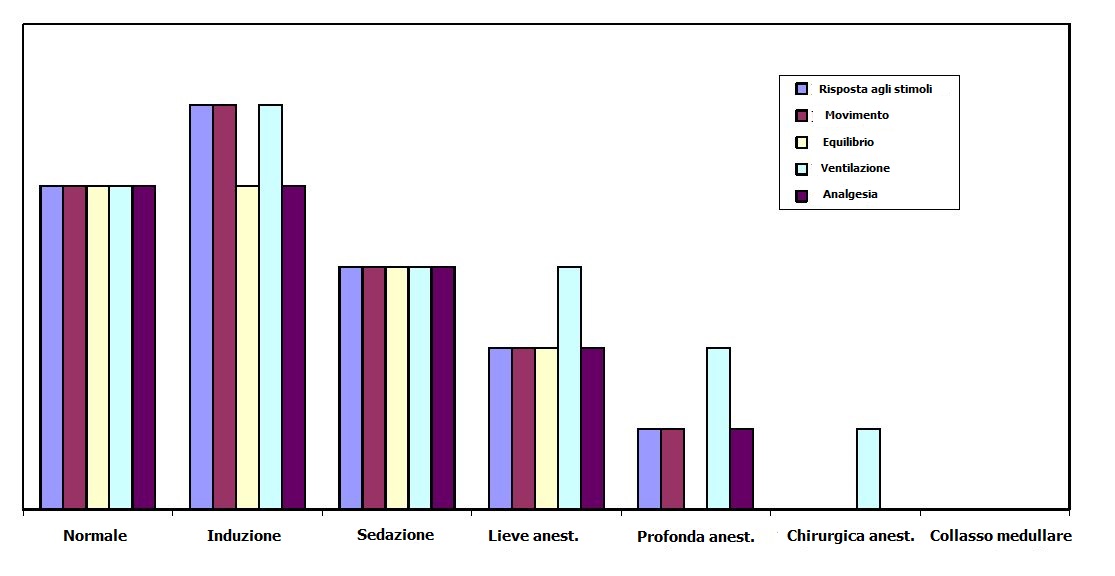
Le fasi e gli stadi di anestesia sono cosi suddivisibili:
| Fasi della Anestesia | ||
| Induzione | Esposizione ad un agente anestetico per ottenere una particolare fase di anestesia. Di solito con un breve periodo di iperattività a causa delle proprietà irritanti dell’agente anestetico | * Evitare i fattori di stress prima che il pesce sia anestetizzato * Durante tutto il processo manipolare il pesce con estrema cura * Mantenere l’areazione perchè molti anestetici causano ipossia e i pesci consumano più ossigeno durante questo processo. Preferibilmente utilizzare ossigeno medicale invece che aria per evitare accidenti di ipersaturazione * L’acqua necessaria per tutte le 3 fasi dovrebbe essere presa dal laghetto * Specialmente durante l’induzione prevenire eventuali salti del pesce *Dopo una prolungata anestesia alcuni farmaci sono altamente concentrati nel sistema nervoso centrale e in altri organi o muscoli. Un flusso costante di acqua aerata, libera da anestetico, contribuisce ad aumentare l’eliminazione dell’anestetico in corpo.
|
| Mantenimento | Monitoraggio dello stadio di anestesia desiderato e controllo dei bisogni fisiologici e d’ambiente come costante rifornimento di ossigeno, la rimozione delle scorie metaboliche mantenimento della temperatura. | |
| Recupero | Riduzione di anestetico e ritorno alla fase normale | |
| Stadi di Anestesia | |||
| Stadio | Livello | Descrizione | Segni visibili nei pesci |
| 0 | Normale | Attività di nuoto e risposta agli stimoli. Buon equilibrio e normale tono muscolare | |
| 1 | 1 | Sedazione leggera | Continua a nuotare con normale equilibrio e tono muscolare. Respirazione normale; Piccola perdita di reazione agli stimoli esterni |
| 2 | Sedazione profonda | Come sopra ma con incremento della frequenza di respirazione e con qualche analgesia; Risponde solo a grosse stimolazioni | |
| 2 | 1 | Anestesia leggera | La frequenza di respirazione è maggiormente depressa; Parziale perdita di equilibrio e di tono muscolare. Buona analgesia |
| 2 | Anestesia profonda | Perdita totale di tono muscolare e di equilibrio. La frequenza respiratoria è molto bassa così come la frequenza cardiaca. Rimangono ancora reazioni a grossi stimoli esterni | |
| 3 | Anestesia chirurgica | Come sopra con totale perdita di reazione anche a stimolazione massiva | |
| 4 | Collasso medullare | Movimento opercolare cessato, arresto cardiaco, morte finale. Overdose | |
I metodi di anestesia nei pesci sono i seguenti, dei quali peraltro il primo tipo è riportato per correttezza espositiva ma non è sicuramente il più seguito.
| Metodi di sedazione o anestesia nei pesci | |||
| Fisici | Ipotermia | ||
| Elettronarcosi | |||
| Chimici
| Inalazione | Droga anestetica in soluzione acquosa | Immersione – induzione e mantenimento |
| Induzione per applicazione branchiale diretta | |||
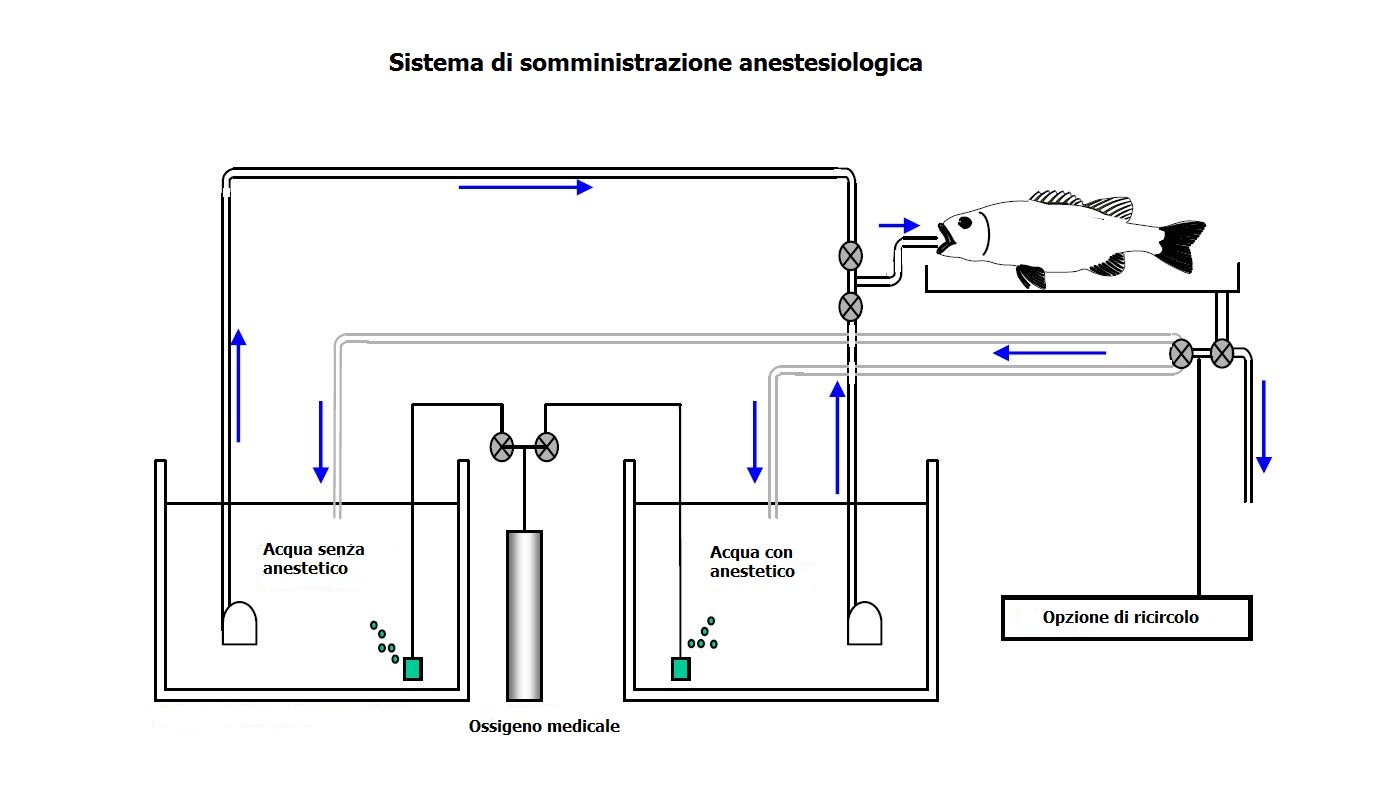
| Mantenimento di ventilazione artificiale (per le procedure più lunghi o quando i pesci devono essere tenuti fuori dall’acqua più di 2-3 minuti) | |||
| Utilizzo di gas | |||
| Parentelare | Intravenosa | ||
| Intraperitoneale | |||
| Intramuscolare | |||
| Caratteristiche ideali di un agente anestetico | ||
| Generale | Agente Chimico | |
| Facile somministrazione | Facile da dissolvere in acqua o in solvente solubile in acqua | |
| Effettivo a basse dosi ed esposizione | Assenza di effetti di iperattività durante l’induzione | |
| Fornisce sedazione o anestesia prevedibile | Assenza di risposta di forte stress | |
| Fornisce buona analgesia | Farmaco facile da ottenere nelle quantità necessarie | |
| Induce velocemente la fase desiderata | Il farmaco deve essere stabile | |
| Facile mantenimeto della fase desiderata | Sicuro per l’operatore | |
| Rapido e tranquillo recupero | Lascia residui trascurabili nei tessuti dopo un recesso di breve tempo | |
| Ampio margine di sicurezza | Innocuo per l’ambiente o rapidamente biodegradabile | |
| Basso costo | ||
Ross, 1999
| Fattori che influenzano l’efficacia dell’anestetico nei pesci | ||
| Biologici | Specie | rapporto peso cervello / massa del corpo |
| Varianza genetica | variabilità fisiologica | |
| Dimensione e peso | differente tasso metabolico | |
| Sesso e maturità sessuale | contenuto lipidico | |
| Contenuto di lipidi | farmaci lipofili / accumulo e recupero più lento | |
| Condizioni corporali | animali esausti, post-riproduzione | |
| Consizioni di salute e stress | animali malati o esausti | |
| Ambientali | Temperatura | Quoziente di temperatura nei poichilotermici |
| pH | Ionizzazione di molecole | |
| Salinità | effetti di tamponamento | |
| Contenuto minerale dell’ambiente | Calcio antagonismo | |
Ross, 2001
L’anestesia per inalazione
Il farmaco anestetico viene diluito in acqua, che lo somministra alle branchie. L’anestetico è assorbito nelle branchie e raggiunge il sistema nervoso centrale tramite il flusso sanguigno.
A seconda del farmaco, l’escrezione avviene principalmente dalle branchie, o secondariamente da altri organi come i reni o anche dalla pelle.
Metodi di anestesia per inalazione:
1 ) Immersione del pesce in una soluzione di anestetico per induzione o per procedure di breve tempo;
2) Induzione per applicazione branchiale diretta con una soluzione ad alta concentrazione, occasionalmente con un innocuo colorante alimentare (Es: 1gr / l di MS222).
3 ) Manutenzione da ventilazione artificiale per le procedure più lunghe. Questo metodo richiede un sistema di erogazione di anestesia con o senza ricircolo. La portata d’acqua deve essere correlata con la dimensione dei pesci e di solito varia tra 1-3L/minute.
| Anestetici di uso comune | ||
| Farmaco | Dosaggio | Commenti |
| MS-222 Tricaina Metasolfonato | Sedazione: 20-30 mg/l
Anestesia: 30-200 mg/l | Anestetico bloccante dei canali del sodio anestetico. Direttamente solubile in acqua. Buon margine di sicurezza. Più potente in acqua tiepida con bassa durezza. L’indice terapeutico diminuisce con la temperatura e con pesci più piccoli. La soluzioni madre fatta di 10g / L in bottiglia sigillata si conserva al buio per 3 mesi; se esposta ad illuminazione può diventare tossica.La soluzione presenta un pH basso, irritante per le branchie, e il suo utilizzo risulta essere molto più sicuro ed efficacie nella sua forma neutralizzata ottenibile portando la soluzione al pH dell’acqua in cui l’animale vive. Per poter tamponare la soluzione si può usare il Bicarbonato di Sodio in rapporto 2:1 con l’MS222.Esempio di soluzione di stoccaggio tamponata: 1 gr di MS222 / 1 gr di sodio bicarbonate / 100 ml di acqua distillata. Tempo di recupero: 3-15 minuti. Liposolubile: recupero più lento nel pesce di età superiore o con femmine gravide. Non è tossico per gli esseri umani. |
| Benzocaina | 40 – 110 ppm | Simile alla Tricaina ma meno acida e meno solubile in acqua. Il composto richiede di essere disciolto in soluzione madre con etanolo o acetone alla dose di 100 g/l o con glicole propilenico. Si conserva in bottiglia scura chiusa, se possibile in frigorifero, per 1 anno. |
| Quinaldina Solfato | 12 – 37 ppm | Irritante con cattivo odore. Le soluzioni sono acide e dovrebbero essere tamponata. Quinaldina: deve essere disciolto in acetone o etanolo. Basso costo. Quinaldine solfato: solubile in acqua, costoso. Cancerogeno. |
| Fenossietanolo | 1 ml per litro d’acqua | Solubile in acqua, se ben miscelato. Stabile ed efficace in un ampio intervallo di pH e temperatura. Soluzione efficace per 3 giorni. Più potente a temperature più basse. Battericida e fungicida. Economico. Dannoso per l’uomo se ingerito, inalato o assorbito attraverso la pelle. |
| Metomidate | 3 – 5 ppm | Farmaci ipnotici non barbiturici (senza fase eccitatoria). Quasi nessuna analgesia. Pochi disturbi elettrolitici e ridotta elevazione del cortisolo. Alcuni autori sostengono che può essere utilizzato come pre-medicazione di anestetici. Altri sostengono che la mancanza di aumento di cortisolo non sia dovuta a meno stress, ma per un effetto inibitorio nella sintesi di cortisolo, che dovrebbe essere evitato in quanto esso provoca una soppressione della risposta infiammatoria e diminuisce le azioni dei leucociti / monociti. Tempo di recupero: 6-12 minuti. |
| Etomidate | Olio di chiodi di garofano | Poiché esistono diverse concentrazioni di olio di garofano sul mercato, normalmente si inizia con 1 ml di olio di garofano per dieci litri di acqua |
| Eugenolo / Koi Calm ® : | Più solubile in acqua calda o in etanolo al 95%. Margine di sicurezza più stretto rispetto al MS222. Durante l’induzione, può verificarsi insufficienza ventilatoria. Proprietà di analgesia sconosciuta. Soluzione madre – 10 mg / L di etanolo efficace per 3 mesi. Economico. Sicuro per gli esseri umani se solo eugenolo. Olio di chiodi di garofano – metileugenolo correlato ad un potenziale cancerogenoAqui-S ® – prodotto ottenuto da olio di chiodi di garofano. Più efficace del solo olio di chiodi di garofano. Buon margine di sicurezza. Economico. Sicuro per l’uomo. | |
| Medetomidina | (Domitor ®) 0,09-0,10 mg/kg | Anestetico iniettabile intramuscolo |
| Etilenglicole monofeniletere | 5 ml /10 litri acqua | |
Allegati : Scheda Tecnica MS 222
Recupero dall’anestesia:
Una volta che la procedura di anestesia viene completata la Koi è rimessa in una vasca di recupero ben areata che dovrebbe contenere acqua della stessa temperatura e qualità di quella usate nell’ induzione dell’anestesia.
Con una leggera pressione tenere la bocca della Koi aperta e spostare il pesce in avanti attraverso l’acqua in modo tale che all’acqua sia permesso passare sopra le branchie ed uscire attraverso gli opercoli. Cercate di non muovere la Koi alternativamente avanti e indietro attraverso l’acqua, in quanto l’acqua che passa all’indietro sopra le lamelle branchiali può causare danni a queste strutture delicate nonchè invertire il normale sistema controcorrente di scambio gassoso con riduzione dell’assorbimento di ossigeno da parte della Koi.
Bibliografia: Fish Sedation, Anaesthesia, Analgesia and Euthanasia: Considerations, Methods and Types of Drugs. Neiffer D.L. et al., 2009